重篤な眼合併症を伴うStevens-Johnson症候群発症に関わる遺伝素因ならびに病態の解明
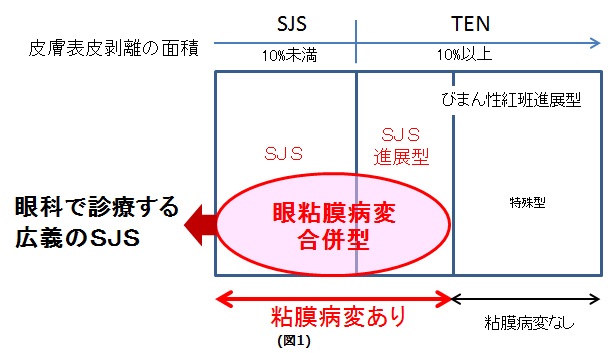
Stevens-Johnson 症候群(SJS)は、突然の高熱、結膜炎、皮膚の発疹につづいて、皮膚・粘膜にびらんと水疱を生じる全身性の皮膚粘膜疾患です。中毒性表皮壊死症(TEN : Toxic Epidermal Necrolysis)は、Stevens-Johnson 症候群の重症型を含んだ病型と考えられ、日本では皮疹の面積が 10%未満のものを SJS、それ以上のものを TEN と呼んでいます。発症率は、1 年あたり百万人に数人で、大変稀な疾患ではありますが、性差なく小児を含めあらゆる年齢に発症します。
眼科では、瘢痕性角結膜上皮症に至った慢性期の患者を診ることが多く、慢性期の所見から
SJSとTENの区別はできませんので、眼科ではSJSとTENを併せて広義のStevens-Johnson
症候群と呼称しています。
SJS/TEN全体における重篤な眼合併症(偽膜ならびに角結膜上皮欠損の両方を認める)発生率は約40%であり、慢性期に眼科を受診するような重篤な眼後遺症を生じるStevens-Johnson症候群患者は、皮膚科でSJSあるいはTEN と診断される患者のうちの一部です(図1)。
重篤な眼合併症を伴うSJS患者では、薬剤投与の前にウイルス感染症やマイコプラズマ感染症を思わせる感冒様症状を呈する事が多く、また、急性期のみならず慢性期にもMRSA・MRSEを高率に保菌し、眼表面炎症と感染症を生じやすいのが特徴です。よって、重篤な眼合併症を伴うStevens-Johnson症候群発症の素因として自然免疫応答異常が関与している可能性を考え、遺伝子発現解析ならびに遺伝子多型解析を行いました。末梢血単球を用いた遺伝子発現解析では、細菌の菌体成分LPSに対するIL-4Rの遺伝子発現が患者とコントロールで異なることを見出しました。
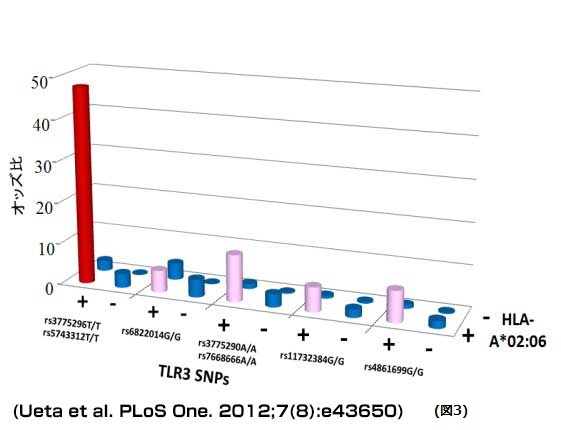
また、候補遺伝子アプローチによる遺伝子多型解析では、このIL-4R、ならびに、TLR3 (Toll like receptor 3: ウイルス由来の二本鎖RNAの受容体)やその他複数の遺伝子多型との有意な関連が確認されました(図2)。さらに、驚くことに、HLA-A*02:06とTLR3 rs3775296T/Tの両方を持つとオッズ比は、47.7にまで上昇することから(図3)、複数の遺伝子多型の組み合わせがこの疾患の発症に大きく貢献している可能性が示唆されました。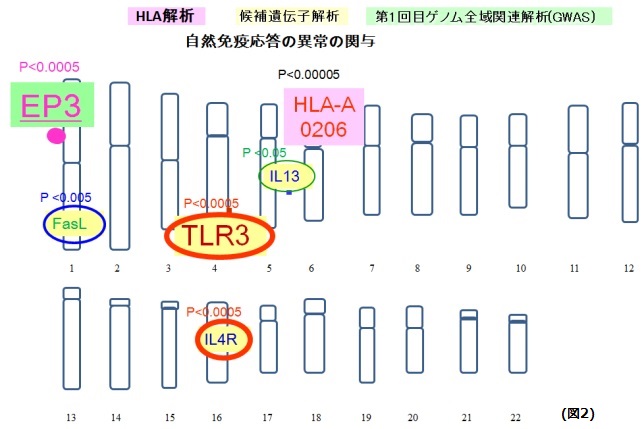
全ゲノム関連解析では、プロスタグランジン(PG)E2の受容体の一つであるEP3の遺伝子PTGER3の遺伝子多型との関連が確認されました。大変興味深いことに重篤な眼合併症を伴うStevens-Johnson症候群患者の眼表面組織では、このEP3タンパクの発現が著明に減少していました(図4)。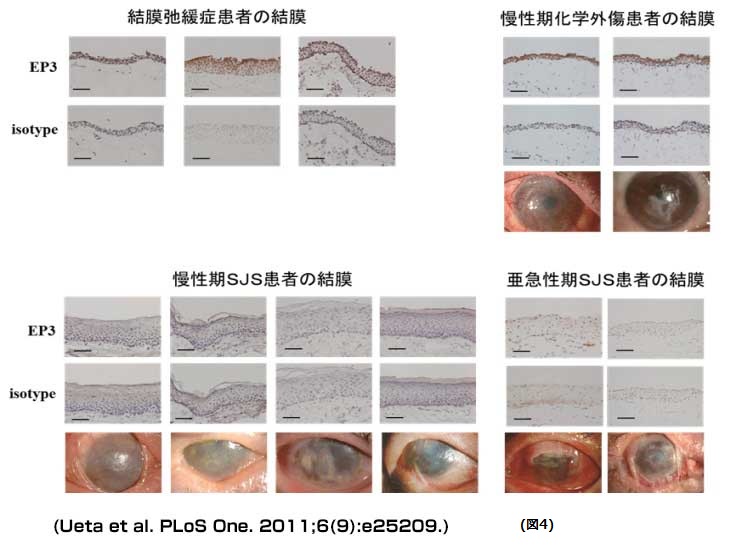
重篤な眼合併症を伴うStevens-Johnson症候群は、薬剤の投与が誘因となって発症することが多く、患者を対象に行った調査では、約8割の患者が感冒様症状を最初に自覚し、感冒様症状に対する薬剤投与が誘因となって発症していました。感冒薬に含まれるアセトアミノフェンやNSAIDsが、EP3のリガンドであるPGE2の産生を抑制することも、重篤な眼合併症を伴うStevens-Johnson症候群発症に大きく関与している可能性が示唆されています。
続いて、重篤な眼合併症を伴うStevens-Johnson症候群のうち、感冒薬により発症した患者に絞って、HLA解析を行ったところ、HLA-A*02:06とHLA-B*44:03に強い関連を認めることが明らかとなりました(表1)。
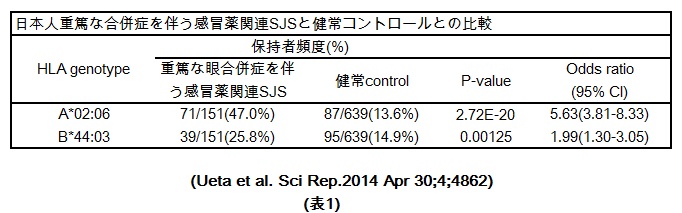
さらに大変興味深いことに、重篤な眼合併症を伴う感冒薬SJSと有意に相関を示すHLA-A*02:06とHLA-B*44:03は、重篤な眼合併症を伴いますが、感冒薬以外で発症しているStevens-Johnson症候群や、重篤な眼合併症を伴わない感冒薬SJS/TENとは関連しません。このことは、HLA-A*02:06とHLA-B*44:03のStevens-Johnson症候群との有意な関連は、感冒薬に関連して発症した重篤な眼合併症を伴うStevens-Johnson症候群に特異的な遺伝子素因であることを示唆しています。
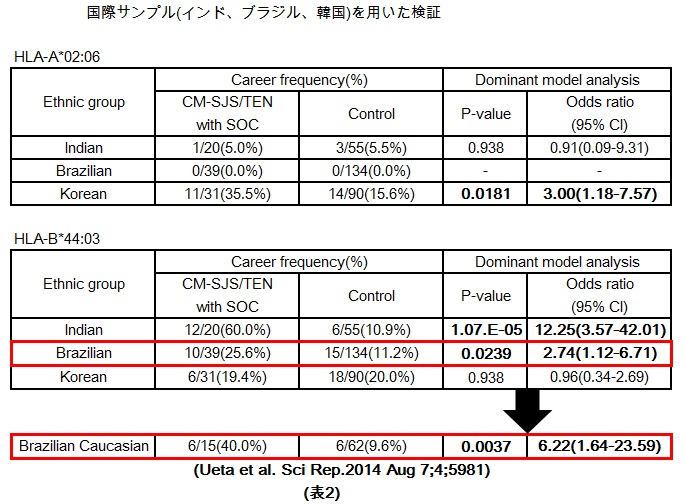
さらに他民族サンプル(韓国、インド、ブラジル)を用いた解析では、HLA-A*02:06は日本人と韓国人と有意な関連を示し、HLA-B*44:03は、日本人、インド人、ブラジル人で有意な関連を認めました(表2)。
特に、HLA-B*44:03が、インド人、白人系ブラジル人で大変強い関連を認めたこと、インド人が人種的に白色人種に属することから、HLA-B*44:03は、白色人種におけるStevens-Johnson症候群発症と強く関連している可能性が示唆されます(表2)。
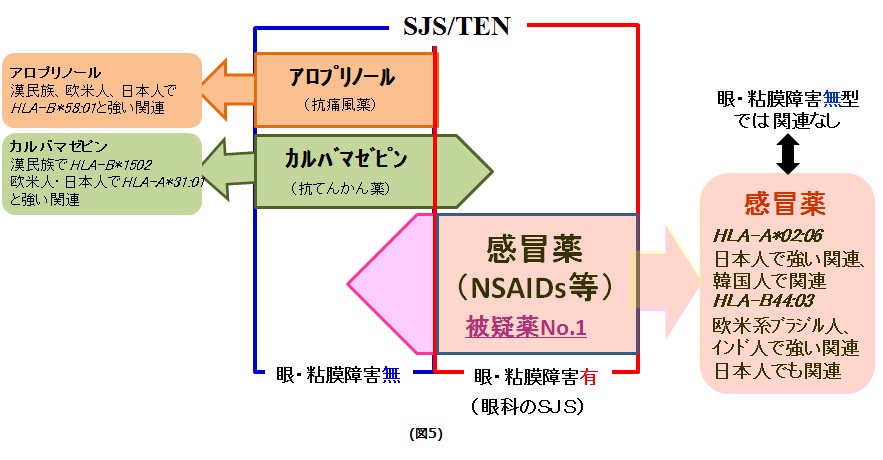
抗痛風薬であるアロプリールにより発症したSJS/TENや、抗てんかん薬であるカルバマゼピンにより発症したSJS/TENの発症に関連するHLA型については、他の多数のグループから報告されています。しかし、感冒薬に関連した発症したStevens-Johnson症候群の発症に関与する遺伝素因について発表しているのは、上田ら京都府立医科大学のグループが世界で初めてです(図5)。
さらに、感冒薬に絞って重篤な眼合併症を伴うStevens-Johnson症候群を対象に、アジア人向けのGeneChipを用いた全ゲノム領域の関連解析を行ったところ、HLA領域以外に、IKZF1遺伝子が強い関連を示しました(図6)。このIKZF1遺伝子多型は、日本人のみならず、韓国人、インド人でも有意な関連を認めたことから感冒薬関連Stevens-Johnson症候群(重篤な眼合併症型)の国際的共通の疾患関連遺伝子であると考えられます。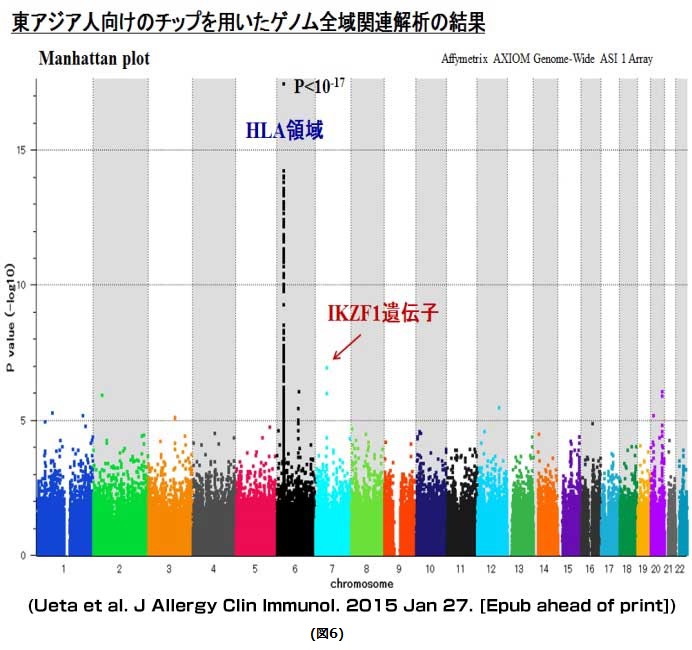
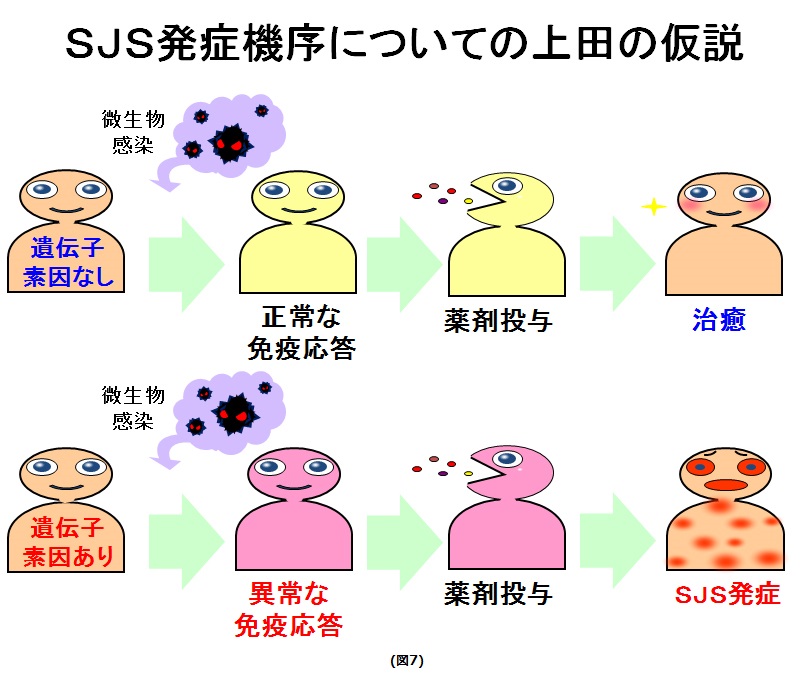
一般に微生物感染が生じても、発症の素因がない人では正常の自然免疫応答が生じ、薬剤服用後に解熱・消炎が促進され、感冒は治癒します。しかし、発症素因がある人に、何らかの微生物感染が生じると異常な自然免疫応答が生じ、その上に、薬剤服用が加わって、異常な免疫応答がさらに助長され、Stevens-Johnson症候群(重篤な眼合併症型)を発症するのではないかと私達は考えて、Stevens-Johnson症候群(重篤な眼合併症型)発症に関わる遺伝素因ならびにその病態の解明を継続しています。(図7)
- ホーム
- 研究テーマ
研究テーマResearch Interests
眼表面炎症性疾患の病態解明
眼表面上皮による炎症制御機構の解明
眼表面は粘膜組織の一つであり、ムチンなどを豊富に含んだ涙液でおおわれ、他の粘膜組織同様に、常在細菌も存在するが、腸管と同様に健常状態では炎症は生じていません。大変興味深いことに、粘膜上皮である眼表面上皮(角膜上皮、結膜上皮)細胞は、免疫担当細胞であるリンパ球やマクロファージとは異なった自然免疫機構を有し、容易に細菌などの菌体成分に対して炎症を惹起しない機構を保持しています(図1)。私達は、眼表面上皮細胞も炎症制御においては重要な役割を担っていると考えています。
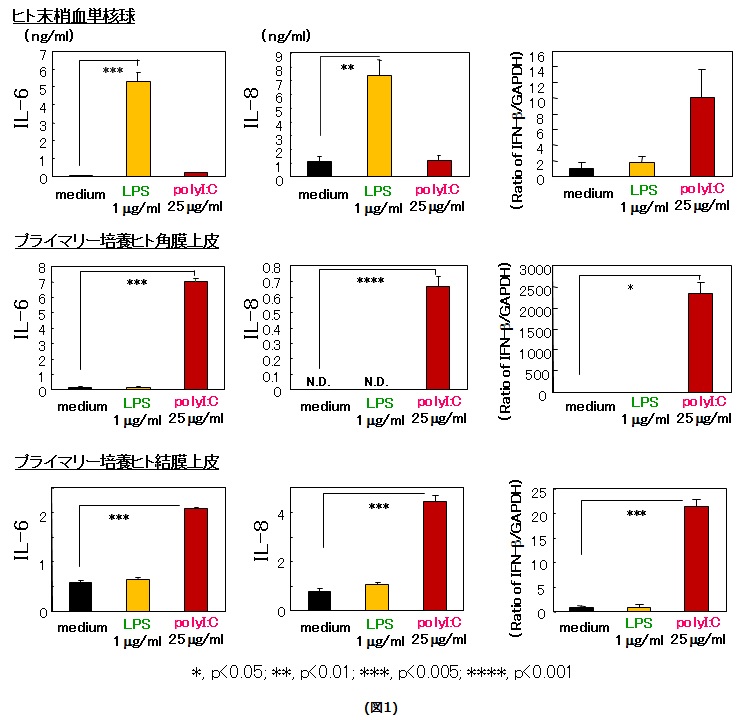
まず、我々は、眼表面上皮に強く発現しているTLR3に着目しました。TLR3は、自然免疫に重要な役割を担うToll-like receptors (TLRs)の一つであり、ウイルス由来の2本鎖RNAを認識し、ウイルス感染において重要な役割を担います。ヒト結膜上皮細胞におけるTLR3の機能を解析する目的で、TLR3のリガンドである2本鎖RNAであるpolyI:C刺激による遺伝子発現変化を網羅的に解析したところ、10倍以上mRNA発現が上昇した遺伝子を47個認めました。そのうちの代表的なこれには以前に報告したIL-6, IL-8, IFN-βが含まれていました。また、残りの代表的な遺伝子の結果を図2に示します(図2)。
CXCL11, CCL20, CXCL10, CCL5, CCL4, IL28Aは、ウイルス感染で発現が上昇すると報告されている自然免疫関連遺伝子であるとともに、アレルギー関連遺伝子でもありました。MDA5,RIG-Iについては、TLR3と同様にウイルス由来2本鎖RNAを認識する細胞内の受容体であったことから、polyI:Cを介した炎症反応がTLR3だけではなく、MDA5やRIG-Iを介して生じている可能性が考えられます。
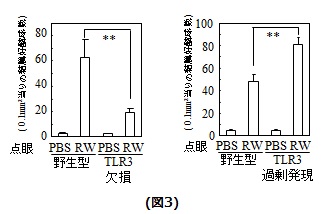
また、TLR3欠損マウス及びTLR3過剰発現マウスにアレルギー性結膜炎を誘発し、結膜好酸球浸潤について解析した結果、TLR3欠損マウスでは、抗原点眼24時間後の結膜好酸球浸潤が野生型マウスと比較して有意に減少し、TLR3過剰発現マウスでは、有意に増加しました(図3)。これらは、TLR3がアレルギー性結膜炎症を促進し、かつ、結膜上皮に発現しているTLR3がその炎症制御に大きく貢献していることを示していると考えられます。
●EP3による炎症性サイトカイン産生抑制ならびにアレルギー性結膜好酸球浸潤抑制作用
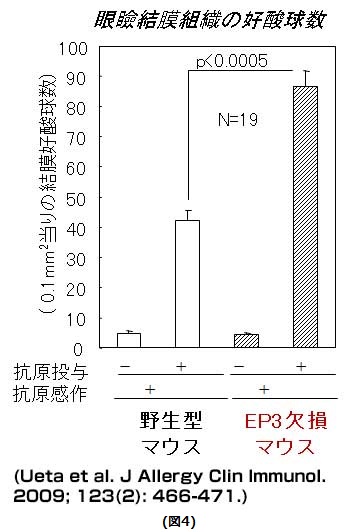
一方、PGE2 はEP3を介してアレルギー性結膜炎を抑制していることも解明しました。EP3欠損マウスにアレルギー性結膜炎を誘発したところ、抗原点眼24時間後の結膜好酸球浸潤が野生型マウスと比較して有意に増加します(図4)。また、大変興味深いことに、EP3は炎症細胞ではなく、眼表面上皮(図5)、表皮、気管上皮などの上皮細胞に強く発現しています。

●TLR3とEP3の相互作用
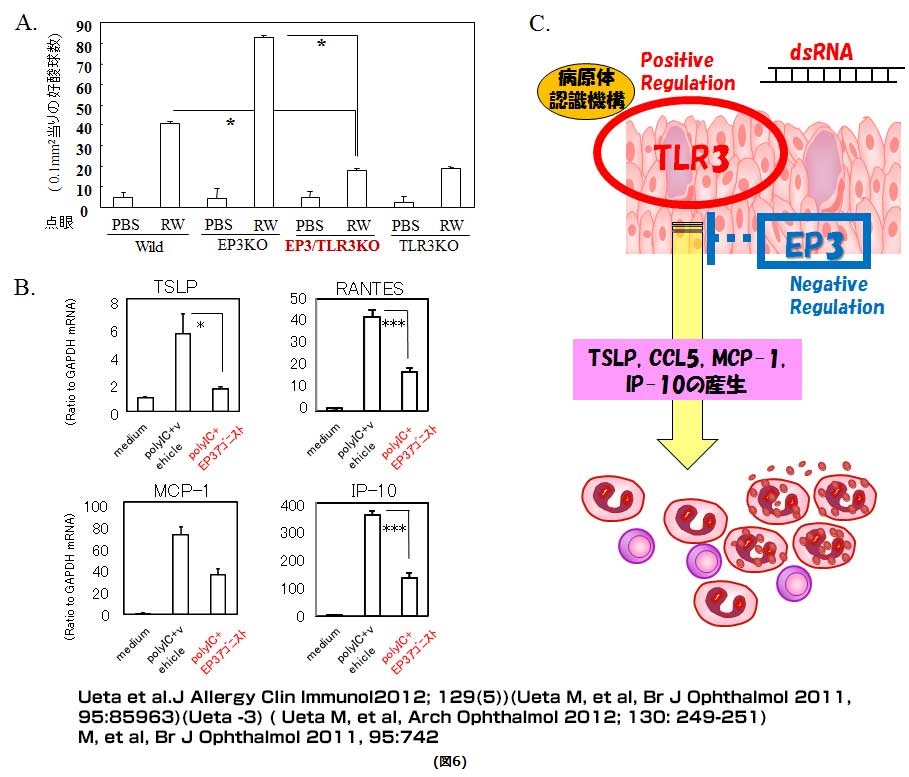
上記のように、TLR3がアレルギー性結膜好酸球浸潤を促進し、EP3がアレルギー性結膜好酸球浸潤を抑制しているということから、我々はTLR3を介したアレルギー炎症促進作用をEP3が抑制する可能性を考えました。そこで,TLR3/EP3二重欠損マウスを作製し,両分子の相互作用について検討した結果、TLR3/EP3二重欠損マウスではアレルギー性結膜好酸球浸潤が抑制される結果となりました(図6A)。また、TLR3を介して結膜上皮から誘導される各種サイトカインをEP3アゴニストが抑制する(図6B)ことより、各種サイトカインの産生をEP3が抑制することによりアレルギー炎症が抑制されている可能性が示されました(図6C)。
 上皮細胞による炎症制御機構を解明することは、その破綻による炎症性疾患の発症機序の解明につながるとともに、今までにない上皮細胞を標的とした新規抗炎症治療薬の開発を可能にすると考えられます。
上皮細胞による炎症制御機構を解明することは、その破綻による炎症性疾患の発症機序の解明につながるとともに、今までにない上皮細胞を標的とした新規抗炎症治療薬の開発を可能にすると考えられます。


